Les Atrophies Optiques Dominantes
La maladie de KJER [kjièr] ou Atrophie Optique Dominante (AOD)
Types d’Atrophies Optiques Dominantes
Atrophie Optique Autosomique Dominante Classique (ou maladie de KJER). C’est la forme d’AOD la plus courante avec une fréquence estimée de 1 cas sur 30 000 naissances. Les symptômes sont uniquement visuels. (plus d’informations sur cette forme)
Atrophie Optique Autosomique Dominante Plus. On appelle ainsi des AOD avec troubles visuels auxquels sont associés d’autres troubles qui ne sont pas visuels. Il est admis que des neuropathies optiques héréditaires caractérisées génétiquement, peuvent s’associer à d’autres manifestations phénotypiques (on parle d’Atrophie Optique syndromique) : cataracte, surdité neurosensorielle, atteinte neurologique évoquant une sclérose en plaques. Ces troubles peuvent être présents seuls ou en même temps chez la même personne (atteinte plurisystémique).
Atrophie Optique Autosomique Dominante avec Cataracte. Le gène OPA3 a été récemment identifié comme responsable d’une forme familiale d’atrophie optique associée systématiquement à une cataracte.
Atrophie Optique Autosomique Dominante avec Surdité. Une atrophie optique dominante peut s’associer à une surdité neurosensorielle, cette association étant spécifiquement due à la mutation R445H sur le gène OPA1. De la même manière que l’atrophie optique, la surdité débute dans l’enfance, s’aggrave progressivement et peut donner des atteintes sévères. C’est la dégradation du nerf auditif qui provoque cette surdité, L’atteinte auditive peut précéder l’atteinte de la vue, qui peut survenir bien plus tardivement.
Compléments
Lenaers G, Hamel CP, Delettre C et al. Dominant Optic Atrophy.Orphanet Journal of Rare Diseases. 2012; 7(46). Traduction française du résumé de cet article.
Site du Syndicat National des Ophtalmologistes de France
Les atrophies optiques récessives
Il existe des Atrophies Optiques Récessives (AOR) beaucoup plus rares que les AOD. Les deux parents doivent porter le gène (ils sont porteurs sains en général). Le risque de transmission de la maladie est de 1/4 à chaque naissance. La fréquence estimée dans la population est globalement d’une personne atteinte sur 1 000 000. Ce sont des maladies toujours avec des troubles associés.
On a identifié des gènes responsables des AOR : ACO2,
- Syndrome de Behr. Le syndrome de Behr est caractérisé par une atrophie optique associée à des manifestations neurologiques. Les deux sexes sont également atteints. L’atrophie optique est responsable d’une diminution de l’acuité visuelle de modérée à sévère d’apparition précoce. L’atteinte visuelle est souvent associée à un nystagmus sensoriel. Les manifestations neurologiques varient d’une famille à l’autre et à l’intérieur d’une même famille. Elles peuvent inclure : épilepsie, paraplégie, dysarthrie, ataxie, incontinence urinaire, retard mental. Ces manifestations neurologiques apparaissent progressivement dans l’enfance et deviennent importantes à partir de l’âge de 10 ans.
- Le syndrome de Wolfram. Le syndrome de Wolfram est une maladie neurodégénérative dont les principaux symptômes sont un diabète sucré de type 1 (Wolfram type 1), un diabète insipide (Wolfram type 2), une surdité, une atrophie optique bilatérale et des signes neurologiques. D’autres complications peuvent y être associées : une atonie des voies urinaires, une ataxie, une neuropathie périphérique, des troubles psychiatriques ou une épilepsie. 90% des cas de syndrome de Wolfram sont du type 1, il est dû à une mutation du gène WFS1. Le syndrome de Wolfram de type 2 est causé par une mutation du gène CISD2. Ce gène régule la production de protéines situées sur la membrane externe des mitochondries. D’autres mutations inconnues sont à l’origine de ce syndrome.
Causes
Le gène OPA1 produit une protéine indispensable au bon fonctionnement des mitochondries. Toute atteinte fonctionnelle d’OPA1 affecte la dynamique et la respiration mitochondriales et augmente la sensibilité des cellules à la mort cellulaire programmée (apoptose). Aujourd’hui, on connait un autre gène, OPA3 – responsable également d’une Atrophie Optique Dominante avec Surdité. Cette étiologie range les AOD dans l’ensemble des, très nombreuses, maladies mitochondriales.
Transmission
Transmission Dominante. Dans ce cas, un seul parent atteint ou porteur sain de la mutation suffit pour transmettre la mutation. La personne porteuse de la mutation a 50% de risque de la transmettre à sa descendance. Ce risque est le même à chaque naissance. Les couples peuvent avoir recours à la PMA pour éviter la transmission à l’enfant.
Néo-mutation. La maladie peut apparaitre chez un enfant alors que les deux parents ne portent aucun gène pathologique muté. Ces mutations sont dites : « de novo » ou « neo-mutation ».
Diagnostic
Les patients sont diagnostiqués, en général, durant la petite enfance quand une perte d’acuité visuelle bilatérale ne peut être compensée avec des lunettes.
L’image du fond de l’œil met en évidence une atteinte du nerf optique. Celle-ci est manifestée par la présence d’une pâleur de la papille (lieu où émerge le nerf optique) qui correspond à la disparition des axones des cellules ganglionnaires de la rétine. Dans les AOD ce signe est bilatéral, symétrique et temporal.
La Tomographie par Cohérence Optique (OCT) est une technique d’imagerie médicale qui, en ophtalmologie, permet de réaliser in-vivo des images en coupe de la rétine. C’est un examen standard de cabinet sans douleur et rapide qui permet d’étudier l’épaisseur de la rétine de l’œil. Dans le cas d’une AOD, la rétine est fine au niveau de la macula à cause du manque de ganglions nerveux (un grand nombre de cellules nerveuses sont mortes, les nerfs et les récepteurs ont disparus).
L’IRM des voies visuelles montre un nerf optique très fin. L’épaisseur du nerf est moindre que chez des personnes saines du fait du moins grand nombre de fibres nerveuses qui le constituent.
Les Potentiels Evoqués Visuels corticaux sont des tests qui étudient l’influx nerveux depuis la rétine jusqu’aux aires visuelles du cerveau. Ces tests, qui utilisent la reconnaissance visuelle de damiers, mettent en évidence des réponses électrophysiologiques anormales dans le cas des AOD.
L’analyse génétique ou moléculaire. Elle est pratiquée que lorsqu’il existe des signes cliniques suffisants. C’est elle qui va confirmer le diagnostic d’AOD. Elle nécessite une prise de sang. Presque toutes les analyses concernant les suspicions d’Atrophie Optique d’origine génétique sont pratiquées dans le laboratoire de biochimie d’Angers (49). Attention : Une analyse moléculaire peut être négative même si les signes cliniques sont certains. En effet, toutes les mutations génétiques des AOD n’ont pas encore été trouvées, on ne peut donc pas les déceler dans l’analyse.
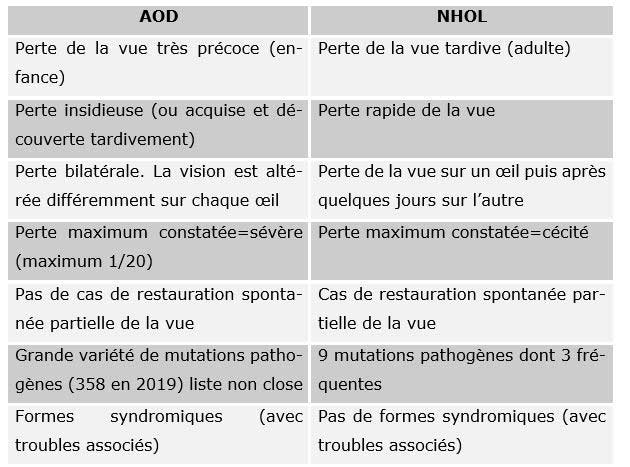
Diagnostic différentiel
Les Atrophies Optiques sont encore mal diagnostiquées (2019). Il existe notamment une confusion fréquente avec la Neuropathie Optique de Leber (NHOL) qui est mieux connue dans le monde médical. Il existe pourtant des différences très nettes entre les deux pathologies qui sont toutes les deux des atrophies bilatérales du nerf optique d’origine génétique à transmission dominante.
Symptômes
Les symptômes des Atrophies Optiques Dominantes (AOD) :
Une perte d’acuité visuelle bilatérale (vision centrale), qui commence généralement durant les 10 premières années de la vie. La perte d’acuité est variable. Dans certains cas, la vue est normale (cas asymptomatique). En général, la perte se situe entre 6/10 et 2/10. L’acuité peut être inférieure à 1/10 jusqu’à 1/20 (niveau de cécité légale). Il n’y a pas de perte totale de la vue. La vision périphérique reste possible, les personnes atteintes conservent une bonne perception de l’espace et du mouvement.
La présence d’un scotome central (très fréquente)
Une limitation du champ visuel (très fréquente)
Une mauvaise perception des couleur ou dyschromatopsie (pas certaine ni importante). Il s’agit souvent mais pas exclusivement d’une altération de la vision du jaune et du bleu).
Environ 15% des patients atteints de AOD présentent des pathologies associées variables : surdité, myopathie, atteinte neurologique centrale évoquant une sclérose en plaques, cataracte. On parle de pathologies syndromiques (plusieurs symptômes).
Evolution
Il existe deux moments délicats dans l’évolution de la maladie : l’adolescence et la période 40-50 ans.
La perte visuelle peut progresser durant l’adolescence et après mais en général de façon très lente. La perte peut être plus importante chez les patients qui ont des troubles associés extra-oculaires (atrophies syndromiques).
Suivi
Comme pour toute maladie chronique des examens réguliers sont recommandés :
Il est préférable de prendre rendez-vous dans un centre spécialisé dans les Atrophies Optiques Génétiques. Voir ici la liste des centres et médecins spécialisés dans les AOD. Faire un examen ophtalmologique régulier pour vérifier l’évolution mais aussi pour corriger d’éventuels problèmes liés à l’œil, et non au nerf optique.
Faire, également, un examen orthoptique régulier.
Traitement
A ce jour, il n’y a pas de traitement des AOD. Les personnes les plus atteintes peuvent bénéficier des aides basse-vision (Voir la vie avec) .
Les recherches thérapeutiques explorent à la fois les possibilités offertes par les thérapies géniques et les thérapies pharmacologiques. La recherche avance très vite, il n’est pas vain d’espérer.
Contre-indications / Précautions
D’une façon générale, les AOD sont des pathologies liées à un dysfonctionnement des mitochondries. C’est sur ce point que la questions des possibles interactions néfastes se pose.
Le déficit mitochondrial est le plus souvent mineur dans les AOD moins que dans les Neuropathie Optiques de Leber. Rappelons à cette occasion que la mutation qui provoque les AOD se situe dans le noyau de la cellule, c’est donc une protéine altérée qui provoque un dysfonctionnement lorsqu’elle est captée par les mitochondries. Dans le cas de la NHOL, c’est le génome mitochondrial qui est directement porteur d’une mutation.
Les porteurs d’une Atrophie Optique Dominante doivent éviter le tabac et l’alcool ainsi que les médicaments qui peuvent interférer avec le métabolisme des mitochondries.
Concernant les possibles interactions médicaments/AOD, selon le Professeur Pascal Reynier (CHU, Angers), il n’y a pas de recommandation officielle actuellement sur laquelle s’appuyer. On sait que beaucoup d’anesthésiques peuvent être toxiques pour la mitochondrie mais ça n’implique pas forcément des complications pour les patients. Il semble qu’il faudrait au moins éviter : Le Propofol en perfusions longue durée et les perfusions de Ringer Lactate dont la toxicité dans les maladies mitochondriales est bien avérée (ainsi que la Dépakine mais elle n’est pas utilisée pour les anesthésies).
Pour finir, il n’y a pas de liens établis entre les Atrophies Optiques Dominantes et le SARS Cov2 responsable de la Covid 19. Cependant, si on vous propose un traitement à base de quinine (chloroquine, hydroxychloroquine). Il faut prévenir le médecin prescripteur que vous êtes porteur d’une maladie mitochondriale C’est une bonne précaution.
De même, il n’y a aucune interaction à craindre entre les vaccin à ARN type Moderna ou BioNTech et les AOD. Pour plus de détails sur ce sujet vous pouvez lire cet article KJER France.
Fréquence de la maladie
La fréquence des AOD dans la population est de 1/10.000 au Danemark (à cause d’un effet fondateur) et 1/30.000 dans le reste du monde. C’est la plus fréquente des Neuropathies Optiques Héréditaires. Les Atrophie Optiques Récessives ont une fréquence de 1 pour un million dans la population générale.
Article original, Éditeur KJER France,01/06/2019
Histoire
 En 1959, l’ophtalmologue danois Paul KJER [ᴋijèr] décrit une atrophie infantile du nerf optique d’origine génétique qui se transmet sur le mode dominant. Un seul parent suffit à transmettre la maladie avec une probabilité d’un risque sur deux. Pour cette raison on parle encore de maladie de KJER. Mais le nom actuel est Atrophie Optique Dominante (AOD) ou Atrophie Optique Autosomique Dominante (AOAD). ADOA en anglais.
En 1959, l’ophtalmologue danois Paul KJER [ᴋijèr] décrit une atrophie infantile du nerf optique d’origine génétique qui se transmet sur le mode dominant. Un seul parent suffit à transmettre la maladie avec une probabilité d’un risque sur deux. Pour cette raison on parle encore de maladie de KJER. Mais le nom actuel est Atrophie Optique Dominante (AOD) ou Atrophie Optique Autosomique Dominante (AOAD). ADOA en anglais.
 En 2000, Une équipe de l’INSERM de Montpellier (France) dirigée par le Dr Guy Lenaers et une équipe britannique ont montré, simultanément, que le gène OPA 1, situé sur le chromosome 3 dans l’ADN du noyau de la cellule, était muté dans la maladie de KJER.
En 2000, Une équipe de l’INSERM de Montpellier (France) dirigée par le Dr Guy Lenaers et une équipe britannique ont montré, simultanément, que le gène OPA 1, situé sur le chromosome 3 dans l’ADN du noyau de la cellule, était muté dans la maladie de KJER.
Les Centres de Référence
Une organisation médicale nationale pour les maladies rares
La loi
La loi n° 2005-102 du 11 février 2005 pour l’égalité des droits et des chances, la participation et la citoyenneté des personnes handicapées a entrainé des modifications radicales de la prise en charge des personnes atteintes de maladies rares.
Un premier Plan National Maladies Rares (PNMR1) a permis de structurer l’organisation de l’offre de soins pour les maladies rares et d’améliorer sa lisibilité pour les patients, les différents acteurs et les structures impliquées dans cette prise en charge.
Les centres de références
Un centre de référence est identifié pour une (ou un groupe de) maladie(s) rare(s) au niveau national.
Actuellement, au nombre de 132 en France et instaurés pour cinq ans dans le cadre d’un plan national, les centres de référence réunissent un ensemble de compétences pluridisciplinaires hospitalières organisées autour d’équipes médicales hautement spécialisées. Labellisés par le ministère de la Santé, ils assurent un rôle d’expertise et de recours. Ils doivent assurer au malade et à ses proches une prise en charge globale et cohérente, améliorer la prise en charge de proximité en lien avec les établissements et professionnels de santé, participer à l’amélioration des connaissances et des pratiques professionnelles, développer les outils de coordination entre les différentes structures et acteurs s’intéressant à la même pathologie, apporter aux autorités administratives les connaissances nécessaires pour évaluer et piloter la politique sanitaire dans le domaine des maladies rares et être les interlocuteurs des associations de malade.
Il y a quatre centres indiqués pour les Atrophies Optiques Dominantes.
Les centres de compétence
Le dispositif des centres de référence a été complété en 2008 par celui des centres de compétences qui ont une vocation régionale. Ces centres de compétences ont vocation à assurer la prise en charge et le suivi des patients, à proximité de leur domicile, et à participer à l’ensemble des missions des centres de référence. Ils travaillent dans le cadre d’un travail en réseau, permettant ainsi de compléter le maillage territorial.
- Les personnes atteintes d’une maladie rare doivent absolument consulter un centre de référence : c’est la garantie d’être suivi et conseillé au mieux.
>>> Liste des centres de référence (voir ci-dessous)
Liste des Centres de Référence
Lieux de consultation spécialisée dans les AOD
En cas de diagnostic d’AOD, il est indispensable de prendre rendez-vous dans le centre de référence le plus proche de chez vous. Vous trouverez ci-dessous, présentés par ordre alphabétique des villes, les coordonnées des 4 Centres de Référence spécialisés dans les AOD.
CHU Angers
Centre National de Référence Neurogénétique
Pr BONNEAU, VERNY
4 rue Larrey
49933 Angers cedex 9
02 41 35 46 13
site : www.neurologie-genetique-chu-angers.fr
mail : voir le site
CHU Montpellier
Centre de Référence des Affections Sensorielles d’Origine Génétique
Dr Isabelle MEUNIER
Hôpital Gui de Chauliac
Département d’ophtalmologie
80, avenue Augustin Fliche
35295 Montpellier cedex 5
04 67 33 02 78
site : www.chu-montpellier.fr
CHU Paris-Necker
Centre de Référence Maladies Rares Ophtalmologie
Pr DUFIER
Service d’ophtalmologie
149 rue de Sèvres
75743 Paris cedex 15
01 42 19 27 02
site : www.hopital-necker.fr
mail : mro.phta@nck.aphp.fr
CHU Strasbourg
Centre de Référence des Affections Ophtalmologiques d’Origine Génétique
Pr Hélène DOLLFUS
| Site Strasbourg 1 | Site Strasbourg 2 |
|
Hôpital Civil site : www.chru-strasbourg.fr |
Hôpital de Hautepierre site : www.chru-strasbourg.fr |
Sur le site
La présence de partenaires n’influence pas la politique éditoriale. Notre site n’accueille pas de publicité. Copyright KJER France – Tous droits réservés.
Ce site respecte les principes de la charte HONcode :
Vérifiez ici.